En el artículo anterior discutimos qué es una reacción redox. Las reacciones redox comúnmente utilizadas en los campos de la farmacia, la biología, la industria, la metalurgia y la agricultura son tipos de reacciones de oxidación y reducción que ocurren simultáneamente. Durante una reacción redox, el número de electrones perdidos es igual al número de electrones ganados.
Las reacciones redox consisten en reacciones de reducción y oxidación. La reducción es el proceso de eliminar oxígeno o elementos electronegativos de una sustancia o agregar hidrógeno o un elemento electropositivo a una sustancia. Mientras tanto, la oxidación es la adición de oxígeno o cualquier elemento electronegativo a una sustancia o la eliminación de hidrógeno o cualquier elemento electropositivo de una sustancia.
Hay varios tipos de reacciones redox con las que estamos familiarizados, incluidas reacciones de combinación, descomposición, intercambio y desproporción.
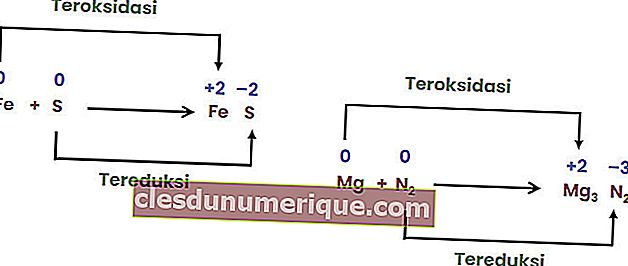
Reacción de combinación
Las reacciones combinadas son reacciones cuando dos o más elementos se combinan para formar un solo compuesto.
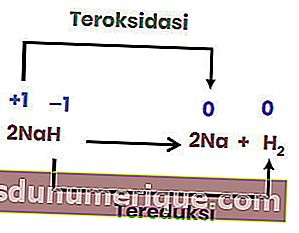
Reaccion de descomposicion
Una descomposición o reacción de descomposición es una reacción cuando un compuesto se descompone o se descompone en dos o más sustancias o elementos simples. Las reacciones de descomposición se denominan comúnmente lo opuesto a las reacciones combinadas.
Sin embargo, no todas las reacciones de descomposición son reacciones redox. Un ejemplo es la siguiente reacción.
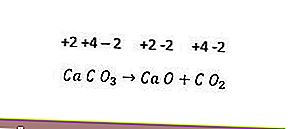
Dado que no hay cambio en el número de oxidación en cada elemento, la reacción anterior no es una reacción redox. Para que una reacción de descomposición se convierta en una reacción redox, al menos uno de los componentes que se forman debe estar en forma elemental.
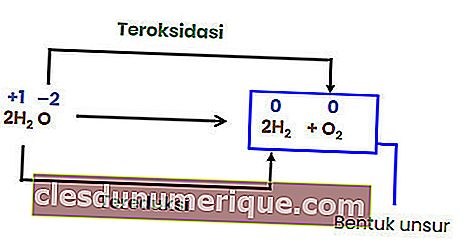
Reacción de intercambio
Una reacción de intercambio o reemplazo es una reacción en la que los átomos o iones de un compuesto se reemplazan por átomos o iones de otro compuesto. Las reacciones de reemplazo se clasifican en reemplazos metálicos y no metálicos.
(Lea también: Descubra las reacciones redox)
El reemplazo de metales ocurre cuando un metal en un compuesto es reemplazado por un metal que es más reactivo en estado libre. Un ejemplo es la reacción a continuación.

Las reacciones de sustitución de metales son útiles en procesos metalúrgicos cuando se obtiene metal puro a partir de los compuestos presentes en el mineral.
Mientras tanto, las reacciones de reemplazo de no metales incluyen el reemplazo de hidrógeno, halógenos y, a veces, oxígeno. Todos los metales alcalinos y algunos metales alcalinotérreos (Ca, Sr y Ba) reemplazan el hidrógeno del agua fría. Se puede ver un ejemplo en la siguiente reacción.
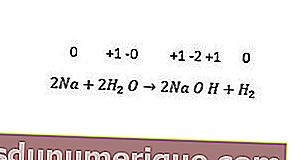
Reacción de desproporción
El último tipo de reacción redox es la desproporción. Esta reacción ocurre cuando el mismo elemento se oxida y reduce simultáneamente. Los elementos que tienen tres o más números de oxidación pueden actuar como sus propios agentes oxidantes y agentes reductores. Un ejemplo es la siguiente reacción.
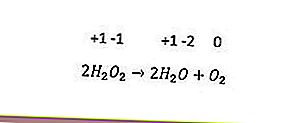
En la reacción anterior, el índice de oxidación del oxígeno (-1) se reduce a -2 y se oxida a 0.









